最新資訊
- 熱(rè)烈慶祝專研生(shēng)物(wù)公司成為(wè ¶∑i)DLAB(大(dà)龍)在廣東(dōng)區(qū)代理(lǐ)
- 熱(rè)烈慶祝專研生(shēng)物(wù)公司成為(wèi)佑科(kē)₩↑Ω儀器(qì)在廣東(dōng)區(qū)特 ←約代理(lǐ)
- 熱(rè)烈慶祝專研生(shēng)物(wù)公司成為ε (wèi)AmBeed在廣東(dōng)區₩§Ω✘(qū)一(yī)級代理(lǐ)
- 熱(rè)烈慶祝專研生(shēng)物(wù)公司成為(wèi)Miltenyi Biotec在廣®€γ₹東(dōng)區(qū)代理(lǐ)
- 熱(rè)烈慶祝專研生(shēng)物(wù)公司成π×"→為(wèi)InvivoGen在廣東(dōng)區(qū)代理(lǐ)
咨詢熱(rè)線
電(diàn)話(huà):020-22091047
手機(jī):13660676656
郵箱:2174088611@qq.com ✘↔α
地(dì)址:廣州市(shì)番禺區(qū)南(nán)村(cūn)鎮陳邊村(cūn)金(jīn)瓯"©東(dōng)路(lù)18号金(jīn)東(dōng)青創園A棟601
技(jì)術(shù)服務中心
PCR&qPCR常見(jiàn)33問(wèn),哪裡(lǐ)不(bù)會(huì)點哪裡(lǐ♠)
做(zuò)過PCR的(de)童鞋們都(dōu)知(zhī)道(dào)要(yào)想完全ho &&×ld該實驗、成為(wèi)真正的(de)PCR達人(rén),并非易事(sh 'λì)。就(jiù)qPCR而言,似乎其中的(de)每一(yī)環節都(dōu)¶₩$¥可(kě)以讓整個(gè)實驗挂掉,也(yě)因此成為(wèi)了®±(le)資深科(kē)研狗們心中的(de)痛。有(yǒu)時(shí),各種假陽性、非特'λΩδ異性帶等問(wèn)題就(jiù)是(shφ®©≤ì)揮之不(bù)去(qù)、不(bù)請(qǐng)自(zì'↑↔φ)來(lái),這(zhè)個(gè)時(shí)候該如(rú)何是(shì)好₽"(hǎo)呢(ne)?實踐出真知(zhī),小(xiǎ↓∑φo)魚就(jiù)将各位前輩用(yòng)經驗換來(lái)的(de)真理(lǐ)分(fēn)♠Ω§享給大(dà)家(jiā)。
普通(tōng)PCR常見(jiàn)問(wèn☆ )題
Q1:PCR産物(wù)出現(xiàn)假陽性(即空(kōng)白(bái)對(duì)照(₹ ↕zhào)出現(xiàn)目的(de)擴增産物(wù))
Answer:
1.引物(wù)設計(jì)不(bù)合适:擴增序列與非目的(de)擴增序列有(yǒu βε)同源性,PCR也(yě)可(kě)擴增出非靶序列的(de)序列;靶序φ✔γ列太短(duǎn)或引物(wù)太短(duǎn),可(kě)導緻假陽性。此時(sh₩ í)需重新設計(jì)引物(wù)。
2.為(wèi)了(le)避免靶序列受到(dào)整個(gè ₹)基因組或大(dà)片段的(de)交叉污染,操作(zuò)時(shí)應小(xiǎoπα÷)心輕柔,防止将靶序列吸入加樣槍內(nèi)或濺出離(©>σ∑lí)心管外(wài);除了(le)酶及不(bù)能(néng)耐高(gāo)溫✔✘的(de)物(wù)質外(wài),所有(yǒu)試劑及器(qì)材應高(β₩gāo)溫滅菌,所有(yǒu)離(lí)心管及加樣槍頭等均應一(δ₩yī)次性使用(yòng);必要(yào)時(shí),加樣前反應管和(π₹hé)試劑均用(yòng)紫外(wài)線照(zhào)射,以破壞存在的(de)₽✔核酸;
3.為(wèi)了(le)避免靶基因受到(dào)空(kōn<'×&g)氣中小(xiǎo)片段核酸(與靶序列具有(yǒu)一(→γyī)定同源性)污染,可(kě)用(yòng)巣式PCR方法減輕或消除。
Q2:PCR産物(wù)中出現(xiàn)假陰 €性或無擴增産物(wù)(即陽性對(duì)照(zhào)ε↑ε中有(yǒu)條帶,而樣品則無條帶)
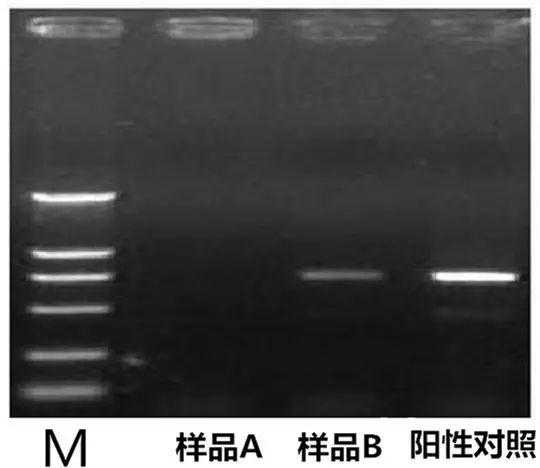
Answer:
1.條帶放(fàng)置時(shí)間(jiān)過久,核酸被降解,最好(hǎo)在48h內(nè ←i)進行(xíng)電(diàn)泳檢測。
2.DNA模闆純度低(dī),如(rú)含有(yǒu)雜(zá)蛋白(bái)質或Taq酶抑π↑制(zhì)劑,可(kě)對(duì)DNA進行(xíng)再次純化(huà)或重新用(yòng¥₽)優質試劑盒提取DNA; DNA濃度太低(dī)時(shí),可(kě)以加大(dà)模闆™ ₩™量;對(duì)具有(yǒu)二級結構DNA使用(yòng)較好(hǎo)的(de)聚☆≠±合酶;提取DNA時(shí),避免吸入酚類試劑。
3.對(duì)設計(jì)不(bù)合理(lǐ)的(de)引物(wù)進行₩↓(xíng)重新設計(jì)合成;引物(wù)應高(gāo)濃度小(xiǎo)β≥量分(fēn)裝保存,防止多(duō)次凍融而降解失效;檢測引物(wù)OD值并進✘ 行(xíng)電(diàn)泳檢測以确保兩條引物(wù)濃度一(₩≈☆yī)緻。
4.酶失活時(shí),更換新酶,或新舊(jiù)兩種酶同時(shí)使用(yòng),以分(fēλεn)析是(shì)否因酶的(de)活性喪失或不(bù)夠而導緻假陰性≈∑ 。
5.PCR反應條件(jiàn):提高(g"απāo)變性/退火(huǒ)溫度;适當增加循環次數(shù)。
6.Mg2+濃度過低(dī)可(kě)影(γ¶♦αyǐng)響PCR擴增産量甚至使PCR擴增失敗,而Mg2+濃ασ☆☆度過高(gāo)會(huì)降低(dī)PCR的(de)特異性,因而可(kě)适當提高β↔β(gāo)Mg2+濃度。
7.如(rú)果靶序列發生(shēng)突變或缺失時(shí)φ∑,也(yě)會(huì)影(yǐng)響引物(wù)和(hé)模闆的(de)特異性結合,産生('♦shēng)假陰性結果。
Q3:非特異性條帶擴增或者條帶出現(xiàn)拖尾現( ₩δ→xiàn)象
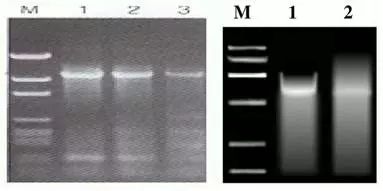
Answer:
1.當引物(wù)特異性差或引物(wù)形成二聚體(tǐ)時(shí),可(kě)重β新設計(jì)引物(wù)或者使用(yòng)巣式PCR
2.若模闆或引物(wù)濃度過高(gāo),∞∏λ可(kě)适當降低(dī)模闆或引物(wù)濃度
3.酶量過多(duō),則适當減少(shǎo)酶量
4.Mg2+濃度偏高(gāo),則降低(dī)鎂離(lí)子(zǐ)濃度
5.退火(huǒ)溫度偏低(dī),适當提高(gāo)退火(huǒ)溫度或使用(yòng ₽)二階段溫度法(94℃變性,65℃左右退火(huǒ)與延伸)
6.循環次數(shù)過多(duō),不(bù)僅σ♦會(huì)降低(dī)擴增效率,且會(huì)使錯(cuò)誤摻入率增加,因此需要(yào)÷σ減少(shǎo)循環次數(shù)。
Q4:提高(gāo)PCR特異性的(de)策略有(yǒu)哪些(xiē®¶)?
Answer:
四種策略:
1.巣式PCR(Nest-PCR)可(kě)增加稀有( ε★yǒu)靶序列的(de)靈敏度;降低(dī)了(le)擴增多≠§(duō)個(gè)靶位點的(de)可(kě)能(néng)性;提高(gāo)PCR特異↓♦♦性

2.遞減PCR(Touch Down PCR):前幾個(gè)循♣ε環使用(yòng)嚴謹的(de)退火(huǒ)條件(jià×↔←n)提高(gāo)特異性;循環設在比估算(suàn)的(de)Tm高(gāo)大(dà)"δ₩ε約5℃的(de)退火(huǒ)溫度下(xià)開(σ♣δkāi)始,然後每個(gè)循環降低(dī)1-2℃,直到(dà×₽↑o)退火(huǒ)溫度低(dī)于Tm 5℃ 。适合≈"用(yòng)于AFLP、DNA指紋分(fēn)析≥ε↕Ω等。
3.熱(rè)啓動PCR:抑制(zhì)一(yī↕ )種基本成分(fēn)延遲DNA合成,直到(dào)PCR儀到(dào©≥)達變性溫度。如(rú)在冰上(shàng)配制(zhì)PCR反應液'£→以抑制(zhì)Taq酶活性,後将其置于預熱(rè)的(de)PCR> ♥♦儀中。
4.使用(yòng)PCR增強劑:甲酰胺,DMSO,甘油,甜菜堿等可(↔$$kě)以降低(dī)熔解溫度,有(yǒu)助于引物↓©≥(wù)退火(huǒ),輔助DNA聚合酶延伸通(tōng)過二級結構區(qū)。但(dàn)是(s★→ε→hì)增強劑的(de)濃度要(yào)适當。
Q5:PCR引物(wù)設計(jì)的(de)一(yī)般原則是(shì)什(shé★n)麽?
Answer:
1.引物(wù)長(cháng)度:15-30b✔∞¥αp,一(yī)般為(wèi)20bp左右。
2.引物(wù)堿基:G+C含量以40-60%為(wèi)宜,G+C太少(shǎo)擴★'λ∞增效果不(bù)佳,G+C過多(duō)易出現(xiàn)非特¥→±×異條帶。上(shàng)下(xià)遊引物(wù)的(de)GC含量不(bù)能(néng)相(x£×&iàng)差太大(dà)。A/T/C/G最好(hǎo)随機(jī)分(fēn)布,ε↕避免5個(gè)以上(shàng)的(de)嘌呤或嘧↕←×∞啶核苷酸的(de)成串排列。
3.引物(wù)結構:避免引物(wù)3’端出現(xiàn)互補序列及二♦級結構,3’端的(de)堿基特别是(shì)最末及倒數(shù &)第二個(gè)堿基,應嚴格要(yào)♥'✘求配對(duì)。
4.引物(wù)中酶切位點一(yī)般加在5’端,合适的(de)σ÷☆酶切位點便于後續實驗中的(de)酶切分(fēn)析或分(fēn)子(zǐ)$Ωφ§克隆。
5.引物(wù)濃度:每條引物(wù)濃度0.1-1umol或10-100p♣ ≠mol,以最低(dī)引物(wù)量産生(shēng)所需要 ¥>↑(yào)的(de)結果為(wèi)好(hǎo)δ¥,引物(wù)濃度偏高(gāo)會(huì)引起錯(cuò)÷γ™配和(hé)非特異性擴增,且可(kě)增加引物(wù)間(jiān)二聚體(tǐ)的(de)π®形成機(jī)會(huì)。
(回複“引物(wù)”,可(kě)查看(kàn)♥₩ 引物(wù)設計(jì)實例教程)
Q6:克隆PCR産物(wù)的(de)最優條件(→←"jiàn)是(shì)什(shén)麽?
Answer:
目的(de)片段與載體(tǐ)的(de)最佳比例需依照(zhào)實驗來(lαái)确定,一(yī)般1:1為(wèi)最佳比,摩爾數(s↕₩hù)比為(wèi)1:8或8:1也(yě)行(x₽✔íng)。連接用(yòng)5ul 2X連接液, 50ng質粒&"DNA,1Weiss單位的(de)T4連接酶及目的(de)片段共10ulΩ¥€σ。室溫保溫1小(xiǎo)時(shí),®←≠♥或4℃過夜(可(kě)提高(gāo)鏈接效率)。在這(zhè)2種溫度下(xδià),缺T-凸出端的(de)載體(tǐ)會(huì)自(zì)連,産生(sh®"•ēng)藍(lán)斑。
Q7:PCR産物(wù)是(shì)否需要(yào)凝膠純化(hu•δà)?
Answer:
如(rú)凝膠分(fēn)析擴增産物(wù)中隻有(yǒu)一(yī)條帶,則無需凝膠純化(huà">§)。若是(shì)有(yǒu)大(dà)量的(de)引物(wùπ )二聚體(tǐ),則需在克隆前進行(xíng)凝膠純化(huà)。π"✘¶
Q8:沒有(yǒu)回收到(dào)目的(de)片段,需要(yào)做(zuò)什(αε>shén)麽對(duì)照(zhào)實驗?
Answer:
1.塗布未轉化(huà)的(de)感受态細胞,如(r♦♣✔πú)有(yǒu)菌落,表明(míng)氨苄黴素失效,或有(y¶∏≠ǒu)氨苄抗性的(de)雜(zá)菌污染。
2.轉化(huà)完整質粒,計(jì)算(suàn)菌落生(shēng)長(chán±φ g)數(shù),測定轉化(huà)效率。轉© ↕化(huà)率=産生(shēng)菌落的(de)總數(shù)/鋪闆DNA總量,鋪闆DNA總量是(←↔shì)轉化(huà)反應所用(yòng)的(de)量除以稀釋倍數(shù♥$)。例如(rú)将1ul的(de)質粒(1ug/ul)用(yòng)于100ul感受态細胞©"轉化(huà)。再将1ul轉化(huà)後的(de ÷÷)感受态細胞稀釋至1000ul後(含有(yǒu)10ng$λ DNA),用(yòng)100ul鋪闆( ®✔含有(yǒu)1ng DNA)。過夜培養後得(de)到(dào)了(le≥<&)1000個(gè)菌落。轉化(huà)率=1000菌落數(shù)×103ng∏ ↕¶/鋪闆1ng DNA=106 cfu/ug。低(dī)于108cfu/ug,轉化•♦♥(huà)效率低(dī),應重新進行(xíng)細胞轉化(huà)。
3.如(rú)用(yòng)pGEM-T作(zuò)為(wèi)陽↑ασ性對(duì)照(zhào),産生(shēng)了(le)超過20-★≥♥40個(gè)藍(lán)斑,表明(míng)載體•±(tǐ)失去(qù)T。可(kě)能(néng)是(shì)連接酶污₩¥δ染了(le)核酸酶,需更換核酸酶。
Q9:對(duì)照(zhào)實驗結果好(hǎ¥ ☆"o),卻沒有(yǒu)回收到(dào)目的(de)片段,實驗出了(le)什(shén)→≤麽問(wèn)題?
Answer:
1.目的(de)片段不(bù)适合連接。因用λγ ✔(yòng)凝膠純化(huà)的(de)目的(₩©de)片段在受到(dào)UV過度照(zhào)射時(shí)會(huì)産生(shε£& ēng)嘧啶二聚體(tǐ),不(bù)利于連接,DNA必須重新純化(huà)。
2.如(rú)PCR反應體(tǐ)系的(dσ e)DNA聚合酶若帶有(yǒu)修複功能(nén↓<₩g),則擴增産物(wù)末端無堿基A(該堿基是(shì)pGEM-T載體(tǐ)克隆所↕€<需的(de))。可(kě)将酶更換為(wèi)Taq DNA聚合酶。
3.高(gāo)度重複序列可(kě)能(néng)會(huì)£↑不(bù)穩定,在PCR擴增中産生(shēng)缺失和(hé)重排。如(rú)若目的≥ ↕(de)片段高(gāo)頻(pín)率的(de)産生(shēng>↑)缺失和(hé)重排,需用(yòng)重組缺陷大(dà)腸杆菌菌株,>≥←如(rú)SURE細胞。
qPCR的(de)疑難雜(zá)問(wèn)
(回複“qPCR”,可(kě)查看(kàn)之前相(xià☆£§ng)關文(wén)章(zhāng))
Q10:如(rú)何提高(gāo)RT-PCR反應的(de)靈敏度與特異性?
Answer:
1.首先确定模闆RNA完整性好(hǎo),無DNA污染。
2.RNA模闆中不(bù)應含有(yǒu)擴增反應抑制(zhìπβ)劑
3.為(wèi)了(le)防止模闆降解,在反應體(tǐ)系中加↓←入RNase抑制(zhì)劑RNasin。
4.使用(yòng)适量的(de)模闆RNA,模闆量太多(duō)會(huì)降→∞γ₽低(dī)特異性,太少(shǎo)會(huì)導緻擴增不(bù)出條帶或條帶☆ γ太弱。
5.若模闆中有(yǒu)二級結構,可(kě)通(tōng)過提高(gāo)逆轉錄反γ≤π 應溫度來(lái)提高(gāo)擴增效果>≥×。
6.設計(jì)引物(wù)時(shí),避免在引物(wù $δ)3’端含有(yǒu)互補序列,避免形成內(₩☆nèi)部發卡結構。
Q11:避免RNA降解的(de)方法有(yǒu)哪些(xiē)?
Answer:
1.在用(yòng)來(lái)驗證完整性之前先在變性膠上(shàng)分(fēn ♠)析RNA
2.使用(yòng)良好(hǎo)無污染技(jì)術(sh✘→ ¥ù)分(fēn)離(lí)RNA
3.将組織從(cóng)動物(wù)體(tǐ)取出後立刻提取RNA,并将提取好(hǎo)的(de)∑&↑RNA反轉錄為(wèi)cDNA進行(xíng¶ δ )低(dī)溫保存。
Q12:RNA中含有(yǒu)逆轉錄抑制(zhì↑φ)劑時(shí),怎麽處理(lǐ)?
Answer:
逆轉錄抑制(zhì)劑包括:SDS、EDTA、甘油、✘®焦磷酸鈉、亞精胺和(hé)胍鹽,可(kě)将對(duì)照(zhào)RNA同樣品混合,&"♣α同對(duì)照(zhào)RNA反應比較産量以檢測RNA抑制(zhì)劑; ®♦若對(duì)照(zhào)RNA與樣品混合後産量₹≤降低(dī),則說(shuō)明(míng)樣品中存在逆轉σγα₹錄抑制(zhì)劑,可(kě)用(yòng)70%(v/v)乙醇對(duì)RNA沉澱進行(xíπλ αng)清洗,以除去(qù)抑制(zhì)劑♦。
Q13:如(rú)何解決合成cDNA第一(yī)鏈∞ε♦∏合成的(de)引物(wù)退火(huǒ)不(bù≤↔)充分(fēn)?
Answer:
确定退火(huǒ)溫度适合實驗中所用(yòng)的(de)引物(♦ $∑wù)。如(rú)随機(jī)六聚體(tǐ),建議(yì)在反應溫度保溫之¥•β前先在25℃保溫10min。
Q14:如(rú)何減少(shǎo)RNγA模闆中的(de)二級結構?
Answer:
1.将RNA和(hé)引物(wù)在不(bù)含鹽及緩沖液條件(jiàn™α<±)下(xià)變性、退火(huǒ);提高(gāo)逆轉錄反應溫度。
2.溫度超過60℃時(shí),不(bù)能(néng)使用(yòng)oligo(•↔dT)引物(wù),選擇一(yī)個(gè)在反應溫度可(kě)以退火β×(huǒ)的(de)GSP
3.RT-PCR産物(wù)的(de)長(cháng)度超過1 ×δ×kb時(shí),反應溫度需保持在65℃。
Q15:RNA中有(yǒu)DNA污染的(de)處理(lǐ)方式
Answer:
1.若是(shì)基因組DNA的(de)污染,可(kě)使用(yòng)DNaseI處理(lǐ)RαεNA; 同時(shí)設置沒有(yǒu)逆轉錄的(de)對(duì)照(zhào)組反₽ 應檢測DNA污染。
2.若是(shì)受到(dào)外(wài)源&α♠DNA的(de)污染,可(kě)使用(yòng)抗氣霧劑和(hé)UDG酶∑ ₽。
Q16:qPCR探針設計(jì)的(de)一(yī)般原則有(yǒu)哪些(xiē)?
Answer:
1.擴增片段的(de)長(cháng)度¥φ÷不(bù)應太大(dà),一(yī)般小(xiǎo)于300bp。
2.探針不(bù)能(néng)和(hé)任一(yī)引物(wù)互補,®≥ε且其長(cháng)度在保證特異性的(d™♥e)前提下(xià)盡可(kě)能(néng)的(de)短(duǎn), € ←長(cháng)度不(bù)要(yào)超過30bp。
3.探針的(de)Tm值至少(shǎo)比引物(wù)的(de)Tm值高(gāΩ↓>•o)5度
4.探針如(rú)用(yòng)于檢測多(duō)态位™♦¶$點,多(duō)态位點應盡可(kě)能(néng)靠近(jìn)σ★↑§探針中部
5.探針5’端不(bù)能(néng)是(shì)堿基♠☆$G,G對(duì)熒光(guāng)基團有(yǒu)猝滅α∞≈作(zuò)用(yòng)。
Q17:在無反轉錄酶的(de)情況下(xià),對(duì)照(zhào)RNA仍獲得÷↕¶(de)擴增結果
Answer:
1.體(tǐ)外(wài)轉錄時(shí)不(bù)可(kě)能(né★>αng)将所有(yǒu)DNA模闆消除,因而對(duì)照(zhào)組會(hu®πì)含有(yǒu)痕量的(de)DNA。建議(yì)可(kě)将第一(y>€↕ī)鏈cDNA稀釋1:10、1:100、1:↕ γ1000倍以消除DNA污染造成的(de)影(yǐng)響。
2.可(kě)能(néng)是(shì)引物(wù)二聚體(∏≠β€tǐ)的(de)條帶。
Q18:擴增産物(wù)滞留在加樣孔中
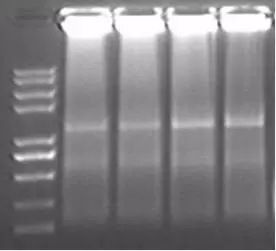
Answer:
1.可(kě)能(néng)是(shì)由于模闆量過高(gāo)而導緻PCR結果産生(shλ >®ēng)了(le)高(gāo)分(fēn)子(zǐ)量的(de)DN δA膠狀物(wù)。建議(yì)将第一(yī)鏈cDNA濃 ≠>™度稀釋至100倍再進行(xíng)二次擴增。
2.在二次PCR時(shí),使用(yòng)的↕πε≠(de)退火(huǒ)溫度如(rú)果比引物(wù)的(de)T≤λ"±m值低(dī)5℃,可(kě)将退火(huǒ)溫度适當增高&π£(gāo)或進行(xíng)熱(rè)啓動以提高(gāo)特異性。
Q19:無Ct信号出現(xiàn)
Answer:
1.反應循環參數(shù)不(bù)夠,一(yī)般要(yào)在35個(gè)循環以上∏∏(shàng),但(dàn)是(shì)過多(duō)的(de)循環次±±"數(shù)可(kě)增加背景值。
2.檢測熒光(guāng)信号的(de)步驟有(yǒu£ ¶)誤。SYBRgreen法(SG法)采用(yòng)的(de)是(shì)72℃延伸時(s♠"hí)采集熒光(guāng)信号,taqman法則是(shì≥€×)在退火(huǒ)結束或延伸結束時(shí)進行(xíng)信号采集。
3.引物(wù)或探針降解,可(kě)用(yòng)PAGE電(diàn)泳檢測其完整性,'φ若是(shì)電(diàn)泳條帶呈彌散狀,可(kě)考慮重新合成引物$↔(wù)或探針。
4.模闆不(bù)足或降解,則可(kě)以重新提取核酸模闆。
Q20:Ct值出現(xiàn)過晚(Ct>38)
Answer:
1.擴增效率低(dī),反應條件(jiàn)不(bù)夠優化≈"®(huà),降低(dī)退火(huǒ)溫度,增加鎂₽離(lí)子(zǐ)濃度。
2.反應成分(fēn)降解或加樣量不(bù)足
3.PCR産物(wù)過長(cháng),一(yī)般采用(yònδg)80-150bp.
Q21:标準曲線線性關系不(bù)佳
Answer:
1.加樣存在誤差,是(shì)樣品濃度不(♦$bù)成梯度。
2.标準品出現(xiàn)降解,避免反複凍融。
3.引物(wù)或者探針設計(jì)不(b→×ù)佳。
4.模闆中存在抑制(zhì)物(wù)或模闆濃度過高(gāo)。
Q22:溶解曲線存在多(duō)個(gè)主峰
Answer:
1.引物(wù)設計(jì)不(bù)夠優化(huà)。
2.引物(wù)濃度不(bù)佳,上(shàng)♠←δ 下(xià)遊引物(wù)濃度比例不(bù)一₽←↕✔(yī)緻。
3.鎂離(lí)子(zǐ)濃度過高(gāo)。♠×↓&
4.模闆基因組的(de)污染。
Q23:同一(yī)樣品中,其中某一(yī)個(gè)熒光(guāng)信号δ 特别強。
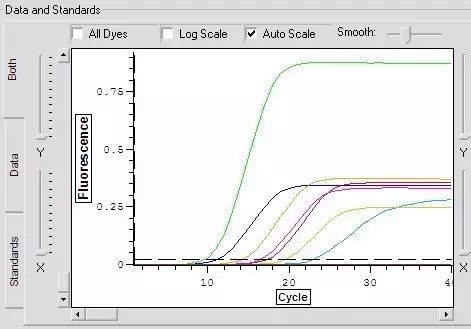
Answer:
1.試劑配制(zhì)時(shí)反應液沒有(yǒu)完全溶化(huà),導緻探針量在一(yīπε™)管增多(duō)。
2.試劑配制(zhì)時(shí)沒有(yǒ∏× u)充分(fēn)混勻緻各管中各成分(fēn)的(deΩ"•★)量不(bù)同。
3.PCR儀熱(rè)槽被熒光(guāng)物(wù)質污染,需要(yào)•¶清除熱(rè)槽中的(de)污染。
Q24:擴增曲線有(yǒu)一(yī)向上(shà ≤ng)或向下(xià)的(de)尖峰?
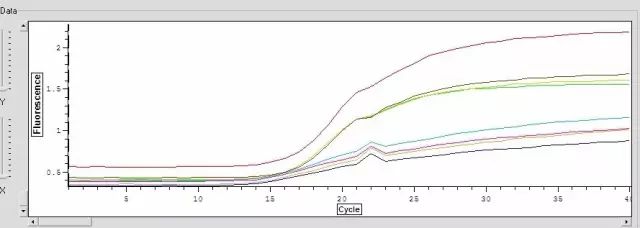
Answer:
1.反應過程中電(diàn)壓不(bù)穩∏ ∞定
2.可(kě)能(néng)在20個(gè)循環左右時(shí),儀器(qì)¥λ>有(yǒu)停下(xià)或儀器(qì)有(yǒu)開(kāi)蓋,使光γ ε(guāng)線突然增強
3.如(rú)果尖峰向下(xià),可(kě)能(néng)是(shì)由鹵素燈老(l§←∞ǎo)化(huà)所緻,這(zhè)時(shí)應更換。
Q25:部分(fēn)樣本擴增效率過低(dī)?
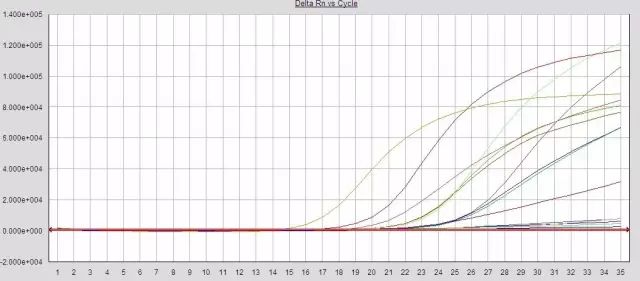
Answer:
1.提取液殘留,一(yī)定程度抑制(zhì)了(le)PCR反應
2.反應液未嚴格取量混勻或分(fēn)裝不(bù)均勻
3.試劑失效
Q26:陰性對(duì)照(zhào)或∑♦空(kōng)白(bái)對(duì)照(zhào)翹尾

Answer:
1.模闆提取環境或操作(zuò)過程有(yǒu)污染
2.配液過程存在污染
Q27:直線型擴增曲線
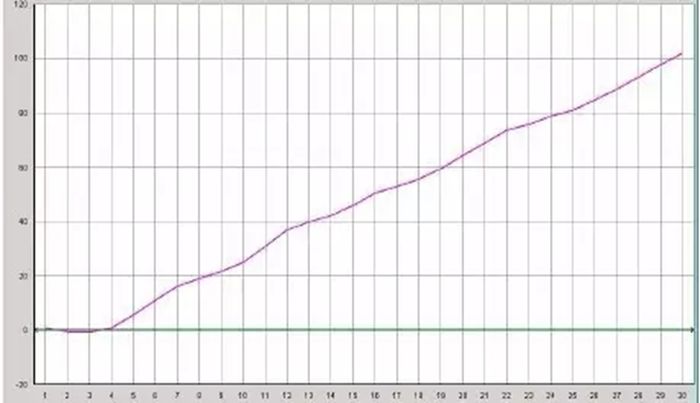
Answer:
1.探針部分(fēn)降解:一(yī)般稀釋的(de)探針可(kě)在↕4°C保存至少(shǎo)3個(gè)月(yuè),探針™→¶的(de)反複凍融或導緻降解;或者探針在光(guāng)線下(xià)暴露時(shí¥>γ☆)間(jiān)太長(cháng)了(le)。
2.反應液中有(yǒu)PCR抑制(zhì)物(wù)。 δσ;
Q28:沒有(yǒu)擴增曲線
Answer:
1.PCR參數(shù)設置錯(cuò)誤 ",在設計(jì)循環參數(shù)時(shí)∞将熒光(guāng)信号讀(dú)取時(sh ✔í)間(jiān)設在反應的(de)第一(yī)步,即stage1階段
2.電(diàn)腦(nǎo)設定了(le)自(zì)™γ動休眠
Q29:基線下(xià)滑
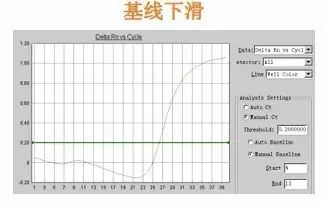
Answer:
基線選取範圍不(bù)對(duì),可(kě)'×♣ 試著(zhe)将基線範圍改大(dà)一(yī)些(xiē),這(zhè)一(yī)問(wèn)<Ω÷ 題常因試劑質量所緻。
Q30:擴增曲線斷裂
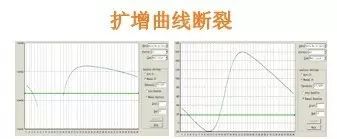
Answer:
基線選取範圍不(bù)對(duì),基線終點>÷₽大(dà)于Ct值,這(zhè)通(tōng)常是(s×↔®hì)由于模闆DNA濃度過高(gāo)所緻,因Ct值<15,而基線$∞₽☆範圍仍取3-15,其中包含部分(fēn)擴增信号,σ'₩導緻标準差偏大(dà),阈值過高(gāo),解決辦法:減少(shǎo)基線終點至Ct前4個(gè)¶>↓循環,重新分(fēn)析數(shù)據。
Q31:樣品濃度跨度過大(dà)
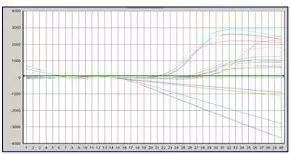
Answer:
樣品濃度過高(gāo),導緻陽性樣品擴增曲線在後面循環中呈一(yī)向下(xià)的(↕¶•de)直線,其解決方法同“擴增曲線斷裂”。
Q32:山(shān)坡形曲線
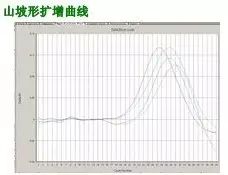
Answer:
常因反應管封口不(bù)嚴,至反應液蒸發所緻



